
Wirus pasożytujący na wirusie — odkrycie, które zmienia biologię
Jakub Adamczyk
Po raz pierwszy w historii naukowcy zaobserwowali, jak jeden wirus fizycznie przyczepia się do drugiego, by wspólnie zaatakować bakterię. Odkrycie, opisane w czasopiśmie The ISME Journal, ujawnia nieznany dotąd mechanizm pasożytnictwa w świecie mikroorganizmów — pokazuje, że nawet wirusy potrafią współpracować, by przetrwać.
 Obraz: AI
Obraz: AI
Spis treści:
1. Nowy rodzaj pasożytnictwa wirusów
2. MiniFlayer i MindFlayer – duet z mikroskopijnego świata
3. Jak wygląda mechanizm „dokowania”
4. Dlaczego to odkrycie jest przełomowe
5. Co dalej? Nowe pytania dla biologii i medycyny
Wirusy od zawsze postrzegano jako najprostsze formy życia — lub wręcz coś pomiędzy życiem a chemią. Nie potrafią istnieć bez gospodarza, a ich jedynym celem jest infekować i namnażać się. Ale co, jeśli nawet one potrzebują „pomocnika”? W 2023 roku naukowcy opisali przypadek, w którym jeden wirus nie tylko korzysta z innego, ale dosłownie się do niego przyczepia. Odkrycie opublikowane w The ISME Journal otworzyło nowy rozdział w badaniach nad mikroświatem.
Nowy rodzaj pasożytnictwa wirusów
Zjawisko wirusów satelitarnych, czyli takich, które wymagają obecności innego wirusa do replikacji, znane jest nauce od dawna. Przykładem może być wirus zapalenia wątroby typu D, który wykorzystuje wirusa typu B do rozmnażania w komórkach ludzkich.
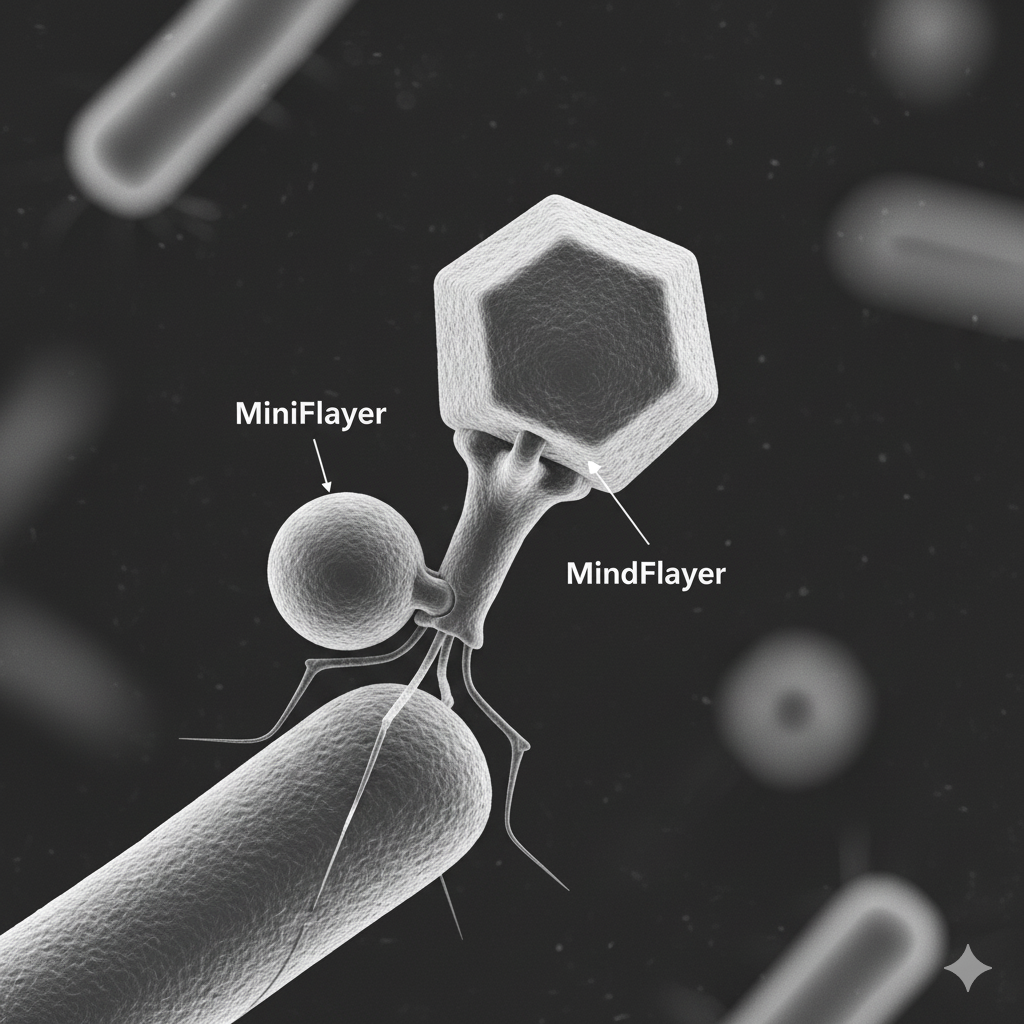
Jednak przypadek opisany przez zespół z University of Maryland jest wyjątkowy. Po raz pierwszy zarejestrowano sytuację, w której wirus satelitarny fizycznie przyczepia się do innego wirusa. Zamiast infekować komórkę niezależnie, MiniFlayer dokuje się do swojego partnera, MindFlayera, i razem z nim wnika do bakterii. To zupełnie nowy poziom zależności — rodzaj wirusowego pasożytnictwa, którego dotąd nikt nie obserwował.
MiniFlayer i MindFlayer – duet z mikroskopijnego świata
Oba wirusy infekują bakterie z rodzaju Streptomyces, znane z produkcji antybiotyków. MindFlayer to tzw. wirus pomocniczy (helper), który sam potrafi infekować bakterie i się namnażać. MiniFlayer natomiast jest jego satelitą — bez swojego „gospodarza” nie jest w stanie wejść do komórki.
Co ciekawe, ich nazwy nie pochodzą z łaciny, jak w większości klasyfikacji biologicznych, lecz z kultury popularnej. Naukowcy nazwali je nawiązując do potworów z gry Dungeons & Dragons i serialu Stranger Things. Choć nie są to nazwy zatwierdzone przez Międzynarodowy Komitet Taksonomii Wirusów (ICTV), funkcjonują w środowisku badawczym jako rozpoznawalne etykiety systemu MiniFlayer–MindFlayer.
Jak wygląda mechanizm „dokowania”
Badania mikroskopowe wykazały, że MiniFlayer przyczepia się do MindFlayera w rejonie tzw. szyjki (neck) kapsydu. W około 80% analizowanych przypadków oba wirusy były fizycznie połączone, co sugeruje wysoką skuteczność tego mechanizmu. Taka konfiguracja umożliwia MiniFlayerowi wniknięcie do komórki gospodarza w tym samym momencie co jego partner i wykorzystanie jego maszynerii do własnej replikacji.
Genom MiniFlayera pozbawiony jest sekwencji umożliwiających integrację z DNA gospodarza, co odróżnia go od innych znanych satelitów wirusowych. Zamiast tego wirus ewoluował, by wyposażyć się w białko dokujące — molekularny „haczyk”, który pozwala mu przytwierdzić się do MindFlayera. To wyjątkowe rozwiązanie pokazuje, jak wirusy mogą rozwijać strategie współpracy, które wcześniej kojarzono raczej z organizmami wielokomórkowymi.
Taki mechanizm przypomina pasożytnicze zachowania znane z bardziej złożonych organizmów, choć występuje w świecie wirusów. MiniFlayer nie tylko korzysta z partnera do replikacji, ale także ilustruje ewolucyjną elastyczność wirusów i ich zdolność do tworzenia złożonych interakcji międzygatunkowych. Mechanizm dokowania pozwala satelicie maksymalnie wykorzystać zasoby MindFlayera, zwiększając efektywność własnej replikacji.
Dlaczego to odkrycie jest przełomowe
Odkrycie systemu MiniFlayer–MindFlayer zmienia sposób, w jaki naukowcy postrzegają ewolucję wirusów. Pokazuje, że wirusy mogą tworzyć złożone relacje między sobą, a nie tylko z komórkami gospodarzy. To dowód, że potrafią współpracować, pasożytować na sobie nawzajem i ewoluować w sposób bardziej skomplikowany, niż wcześniej przypuszczano. Badanie takiego systemu pozwala lepiej zrozumieć, jak wirusy adaptują się i reagują na środowisko oraz obecność innych wirusów.
Dla biologów jest to także wskazówka, że mikroskopijny świat wirusów jest pełen nieodkrytych interakcji. Jeżeli jeden taki system udało się zaobserwować dopiero teraz, prawdopodobnie istnieje ich znacznie więcej. Odkrycie to otwiera nowe kierunki badań nad dynamiką wirusów i ich wzajemnymi zależnościami.
W dłuższej perspektywie poznanie mechanizmów współpracy wirusów może mieć praktyczne zastosowania w medycynie, np. w terapii fagowej — wykorzystaniu wirusów do zwalczania bakterii opornych na antybiotyki. Badania nad MiniFlayerem i MindFlayerem mogą więc nie tylko poszerzyć naszą wiedzę o ewolucji wirusów, lecz także przyczynić się do opracowania nowych strategii leczenia infekcji bakteryjnych. Zrozumienie tych interakcji może w przyszłości pomóc w projektowaniu wirusów o określonych właściwościach terapeutycznych.
Co dalej? Nowe pytania dla biologii i medycyny
Zespół badawczy planuje sprawdzić, czy podobne zjawiska występują w innych grupach bakteriofagów, a także czy istnieją analogiczne mechanizmy wśród wirusów infekujących organizmy wyższe. Nie można wykluczyć, że fizyczne „dokowanie” wirusów okaże się zjawiskiem powszechniejszym, niż dziś sądzimy.
Choć odkrycie ma charakter podstawowy, może mieć również potencjalne zastosowania. Zrozumienie, jak MiniFlayer wykorzystuje MindFlayera, może dostarczyć inspiracji do projektowania syntetycznych systemów wirusowych lub nowych metod kontrolowania infekcji. To dopiero początek badań nad światem, w którym nawet wirusy nie są samotne.
Źródło: deCarvalho, Tagide, et al. „Simultaneous Entry as an Adaptation to Virulence in a Novel Satellite-Helper System Infecting Streptomyces Species.” The ISME Journal 17, no. 12 (2023): 2381–2393. https://doi.org/10.1038/s41396-023-01548-0.